 |
Амедео Авогадро
1776—1856
«Очерк метода определения относительных масс элементарных молекул тел и пропорций, согласно которым они входят в соединения» Авогадро (1811)
Нет ничего удивительного в том, что Авогадро начал свою научную деятельность именно с изучения электрических явлений. Электричество и магнетизм давно уже привлекали внимание ученых. Этот интерес особенно усилился после того, как Вольта в 1800 году изобрел первый источник электрического тока (вольтов столб), а также в связи с дискуссией между Гальвани и Вольта о природе электричества. Эти вопросы находились на переднем крае науки того времени, и естественно, что молодой Авогадро решил попробовать свои силы именно здесь. Работы, Авогадро, посвященные разным проблемам электричества, появлялись вплоть до 1846 года. Большое внимание уделял он также исследованиям в области электрохимии, пытаясь найти связь между электрическими и химическими явлениями, что привело его к созданию своеобразной электрохимической теории. В этом отношении его исследования соприкасались с работами знаменитых химиков Дэви и Берцелиуса. Но в историю физики Авогадро вошел как автор одного из важнейших законов молекулярной физики.
В 1811 году статьи Авогадро «Очерк метода определения относительных масс элементарных молекул тел и пропорций, согласно которым они входят в соединения». Излагая основные представления молекулярной теории, Авогадро показал, что она не только не противоречит данным, полученным Гей-Люссаком, но, напротив, прекрасно согласуется с ними и открывает возможность точного определения атомных масс, состава молекул и характера происходящих химических реакций. Для этого прежде всего необходимо предположить, что молекулы водорода, кислорода, хлора и некоторых других простых веществ состоят не из одного, а из двух атомов.
В этой же работе Авогадро пришел к следующему важному заключению: «... число ... молекул всегда одно и то же в одинаковых объемах любых газов». (Разумеется, объемы измерены при одинаковых давлениях и температурах.)
Далее он писал, что теперь «имеется средство очень легкого определения относительных масс молекул тел, которые можно получить в газообразном состоянии, и относительного числа молекул в соединениях».
В самом деле, отношение масс молекул такое же, как и отношение плотностей газов при одинаковых давлениях и температурах. Если у нас есть два разных газа, массы которых равны М1 и М2, а объемы, измеренные при одинаковых температурах и давлениях,— соответственно V1 и V2, то, следуя Авогадро, мы можем написать такое соотношение:
![]()
где m1 и m2 — массы молекул первого и второго газов, a N1 и N2 — число таких молекул в объемах V1 и V2. Разделив в этом выражении числители обеих дробей на V1, а знаменатели на V2, получим:
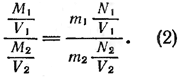
Но M1/V1 и M2/V2 — плотности газов p1 и p2, a N1/V1 и N2/V2 — числа молекул в единице объема. Согласно Авогадро N1/V1 = N2/V2. При этом соотношение (2) принимает следующий вид:
![]()
Авогадро приводит такой пример: плотности кислорода и водорода равны 1,10359 и 0,07321 (за единицу принята плотность атмосферного воздуха). Следовательно, отношение масс молекул кислорода и водорода примерно равно
![]()
По более точным данным масса молекулы кислорода в 16 раз больше массы молекулы водорода.
Из опытов Гей-Люссака следует, что для образования двух каких-либо одинаковых объемов водяного пара необходимо два таких же объема водорода и один объем кислорода. Значит, на каждую молекулу кислорода приходится по две молекулы водорода. Если бы молекулы водорода и кислорода состояли из одного атома, то мы имели бы реакцию 2Н+O=Н2О, в результате которой из двух объемов водорода и одного объема кислорода получился бы один объем воды. Но это противоречит результатам опытов Гей-Люссака. Следовательно, приходится предположить, что в каждом элементарном акте реакции возникает по две молекулы воды (2Н20), а молекулы кислорода и водорода содержат по два атома (02 и Н2). Так мы приходим к правильной формуле реакции:
2Н2 + 02 = 2Н20.
Эта хорошо нам знакомая формула впервые была получена Авогадро.
По материалам книги
"Замечательные ученые"
под ред. С.П. Капицы
© Все права сохранены. Initeh.ru